上期我们就巨噬细胞的靶向策略进行了实例分析。在免疫细胞中,T细胞充当着不可或缺的角色。它们具有特异性和记忆性,可以被激活并产生针对病原体或肿瘤细胞的免疫反反应。T细胞分为多种类型,包括Th细胞、Tc细胞、Treg细胞等。它们在免疫系统中发挥着不同的作用。探究T细胞在免疫系统中的作用对于理解和治疗与T细胞相关的疾病具有重要意义。针对T细胞的靶向策略的研究也有助于我们开发更有效的免疫治疗方法。这期我们将结合实例分析T细胞在文献中利用AAV的靶向策略。
The TLR9-MyD88 pathway is critical for adaptive immune responses to adenoassociated virus gene therapy vectors in mice [1]

主要内容
在这篇研究表明AAV通过TLR9激活小鼠浆细胞DCs,产生Ⅱ型FNs。在体内,TLR9-MyD88途径对于AAV激活CD8 T细胞以及特异性的AAV中和抗体的产生至关重要。研究人员还证明,TLR9依赖性激活针对AAV的适应性免疫是由I型IFNs介导的,人类pDCs可以在体外被激活以诱导I型IFN的产生,这些结果都揭示了TLR9-MyD88Ⅰ型IFN途径的重要作用,干扰这一途径可能会改善AAV介导的人类基因治疗的结果。
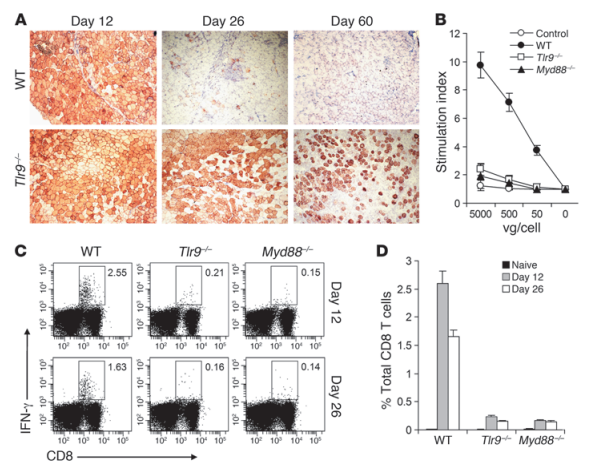
如下图,研究人员为了确定TLR9-MyD88途径的生物学意义,建立了一个小鼠骨骼肌介导的基因转移模型。A可以看出AAV2-HA的表达是暂时的,60天完全消失。B图展示了标准的T细胞增殖实验分析了脾细胞的病毒特异性T细胞的激活情况。在WT小鼠中,AAV感染导致强大的T细胞激活,而在Tlr9-/-或Myd88-/-小鼠中,T细胞的激活被明显削弱了。这些结果表明,TLR9-MyD88途径是激活AAV特异性T细胞的关键,导致转基因在体内表达的损失。之后研究人员进一步对细胞毒性的CD8 T细胞对AAV2外壳的反应进行了研究。在Tlr9-/-或Myd88-/-小鼠中,CD8+T细胞对AAV外壳的反应对比WT都有明显减少。这些结果都表明,完整的TLR9-MyD88途径是必需的。
病毒产品 | AAV2-CMV |
实验动物 | C57BL/6& BALB/C |
注射方式 | 腹腔注射 |
注射量 | 1×1011 vg |
An evolved AAV variant enables efficient genetic engineering of murine T cells[2]

主要内容
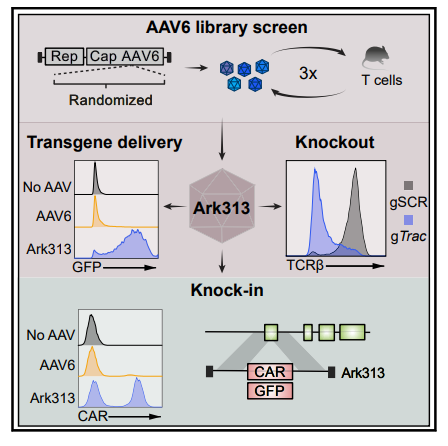
该研究在AAV6的基础上进化出了一种能够高效转导小鼠T细胞的AAV变体Ark313,并通过CRISPR全基因组筛选确定了QA2是Ark313高效转导的重要因素。Ark313能够实现向小鼠T细胞的高效转基因递送和大片段DNA的有效精确靶向整合,可用于构建更安全更精确的CAR-T和TCR-T细胞。
利用同源定向修复(HDR)将大片段DNA精确靶向并插入到T细胞,已经成为T细胞疗法的变革性手段。使用腺相关病毒(AAV)来递送大片段DNA模板,大大提高了基因插入的效率,但目前仍然缺少一种高效转导T细胞的AAV血清型。为了实现在小鼠T细胞中的靶向基因敲入,研究团队构建了一基于在AAV6型(AAV6)的AAV衣壳库,在此基础上改造进化出了新的AAV血清型——Ark313,其在小鼠T细胞中表现出高转导效率。研究团队还通过基于CRISPR的全基因组敲除筛选,确定小鼠QA淋巴细胞抗原2(QA2)是Ark313能够高效感染的重要因素。接下来,研究团队证明了Ark313可实现对小鼠T细胞高效的不整合的DNA递送、CRISPR-Cas9介导的基因敲除,以及大片段DNA的定向整合。
更重要的是,Ark313能够用于构建TRAC靶向的CAR-T细胞和转基因的TCR-T细胞。这一高效的靶向小鼠T细胞的腺相关病毒血清型为改进T细胞疗法提供了巨大潜力,也为T细胞免疫学研究开辟了新的道路。
病毒产品 | Ark313-U6 |
注射方式 | 直接分离培养原代T细胞 |
注射量 | MOI=1*104 |
Optimizing rAAV6 transduction of primary T cells for the generation of anti-CD19 AAV-CAR-T cells[3]

主要内容
rAAV是目前最广泛使用的基因传递载体,其优点是免疫原性低,几乎没有毒性。然而它对原代细胞的转染效率低,特别是T淋巴细胞。在这项研究中,研究人员优化了rAAV6转导原代T细胞的方案,显著提高了rAAV6传递的CAR基因的表达效率,并成功产生了基于rAAV6的CAR-T细胞(AAV-CAR-T)。此外本研究还表明,rAAV6有效地转导了用OKT3(CD3单克隆抗体)和GENISTEIN(酪氨酸蛋白酶抑制剂)刺激的T细胞。基于上述优化的方法,用rAAV6制备的CAR-T细胞显示出明显的体外和体内的抗肿瘤能力。本研究结果建立了一种高效的AAV转导T细胞的方法,并将为CAR-T细胞的制备提供一种替代方法。
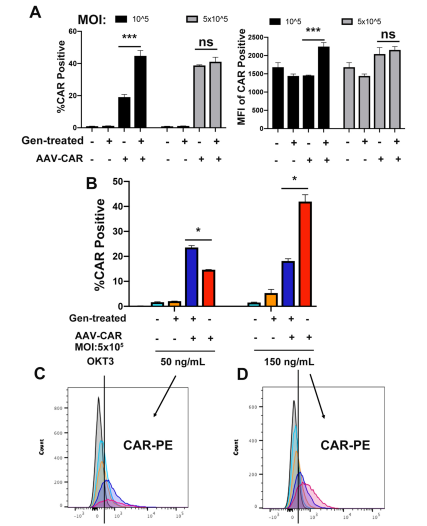
如下图,为了证实优化的方法是否也能提高CAR在T细胞中的表达效率,研究人员使用携带CAR的rAAV6在CMV启动子的控制下转染Jurkat细胞。如A所示,基因改造组的CAR表达量从20%提高到了44%。原代T细胞培养7-10天进行细胞扩增,然后用rAAVCMV-CAR病毒进行转导。在MOI为5 *105时,经过GENISTEIN处理的原代T细胞转导效率增加了23%。此外,在高浓度的OKT3(150纳克/毫升)条件下,CAR的表达效率在5*105的MOI下增加了40%。
病毒产品 | AAV6-CMV |
实验动物 | C57BL/6& BALB/C |
注射方式 | 腹腔注射 |
注射量 | 1×1011 vg |
拓展阅读
AAV在免疫细胞中的靶向策略(实例分析篇之巨噬细胞)

公众号底部菜单栏【新功能】上线!
病毒实验帮
免费在线学习《国自然热点研究》、《数据库及软件操作教程》
一键下载《病毒使用手册》、《高分文献》
还有不定时的送新书、抽奖活动,赶紧来扫码关注一波吧
参考文献…
1. Zhu, J., X. Huang, and Y. Yang, The TLR9-MyD88 pathway is critical for adaptive immune responses to adeno-associated virus gene therapy vectors in mice. J Clin Invest, 2009. 119(8): p. 2388-98.
2. Nyberg, W.A., et al., An evolved AAV variant enables efficient genetic engineering of murine T cells. Cell, 2023. 186(2): p. 446-460 e19.
3. Wang, D., et al., Optimizing rAAV6 transduction of primary T cells for the generation of anti-CD19 AAV-CAR-T cells. Biomed Pharmacother, 2022. 150: p. 113027.
