导读聚焦
本期导读多篇顶刊论文聚焦肠道微生物与代谢调控领域研究成果,揭示其与健康、疾病的核心关联。
在代谢健康调控层面,Nature Communications研究揭示高纤维饮食可模拟哺乳动物年龄相关的热量限制特征;Cell Metabolism两篇研究则分别发现通过底物捕获来自肠菌D-乳酸防止其进入体内能改善肥胖小鼠糖代谢与脂肪肝病,以及乙酰化纤维素借肠道共生菌消耗碳水以抑制体重增加;Cell Reports一文发现葡萄糖激活的组蛋白去甲基化酶JMJD1A通过染色质重塑驱动内脏脂肪生成。
在耐药菌研究层面,Nature Microbiology一文证实代谢重编程可增强耐药菌对抗生素的敏感性;Cell Host & Microbe研究阐明氨基酸竞争影响耐药菌鲍曼不动杆菌肠道定植。
在肠菌代谢机制层面,Cancer Discovery研究结果指出食品添加剂三氯蔗糖会破坏肠菌致癌症免疫疗法失效,Cell论文发表以AI技术破解肠道微生物胆汁酸代谢酶奥秘,这些研究成果为健康管理与疾病防治提供关键新视角。
导读目录
1. Nature Communications丨高纤维饮食模拟哺乳动物中与年龄相关的热量限制特征
2. Nature Microbiology|代谢重编程增强多重耐药和碳青霉烯类耐药细菌对抗生素的敏感性
3. Cell Metabolism | 肠道底物捕获肠菌D-乳酸改善肥胖小鼠糖代谢和脂肪肝病
4. Cell | AI揭示肠道微生物的胆汁酸代谢酶奥秘
5. Cancer Discovery | 三氯蔗糖的摄入通过破坏肠菌使癌症的免疫疗法失效
6. Cell Host & Microbe | 氨基酸竞争影响鲍曼不动杆菌肠道定植
7. Cell Metabolism | 乙酰化纤维素通过肠道共生菌消耗宿主可利用的碳水化合物来抑制体重增加
8. Cell Reports | 葡萄糖激活的JMJD1A通过α-酮戊二酸依赖的染色质重塑驱动内脏脂肪生成
资源领取
本期导读文献原文,请在公众号后台回复“2025年8月绘谱导读”,即可获取资源链接。
一、Nature Communications丨高纤维饮食模拟哺乳动物中与年龄相关的热量限制特征

热量限制(CR)通过延缓生长发育、增强代谢稳态延缓多种生物的衰老,但需限制进食,而理想的热量限制模拟物(CRM)仍待探索。本研究开发了一种高纤维饮食(CF30m,30%宏量营养素被不可消化纤维素替代),发现其在不减少食物摄入的情况下,可模拟CR的抗衰老特征,改善不同年龄段雄性小鼠的代谢、运动及认知功能,为健康与衰老研究提供了新候选方案。
● 1. 首先比较了高纤维饮食与CR的基础表型差异,以年轻雄性C57BL/6J小鼠为对象,设置CF30m等高纤维饮食组、CR组(夜间2小时进食)及常规饮食(RD)组。结果显示,CF30m组食物摄入量比RD组高47%,但体重、热量及宏量营养素摄入无显著增加;CR组食物摄入减少20%,体重比RD组低17%。两种饮食均未影响小鼠生长趋势,且CF30m的适口性随适应期延长与其他组趋同。
● 2. 接下来分析转录组特征,对小鼠肝组织进行RNA-seq发现,CF30m与CR的差异表达基因(DEGs)高度重叠,共853个上调基因和1672个下调基因,均富集于能量代谢、脂质代谢等通路,并共同下调生长发育及炎症相关基因。其中CF30m独特下调的基因更富集于免疫反应,且与衰老相关基因重叠度更高,提示其在抑制衰老相关免疫过程中的独特作用。
● 3. 随后研究代谢组变化,发现CF30m与CR的肝脏代谢物变化相似,均上调脂质代谢相关物质(如亚油酸、γ-生育三烯酚),下调毒素类物质(如半乳糖醇);但CF30m对脂质代谢的影响更显著,涉及192种脂质及类脂质化合物,且其作用不依赖短链脂肪酸(SCFA)或酮体。
● 4. 最后评估对中年及自然衰老小鼠的效果,结果表明,6月龄小鼠经CF30m干预4个月后,葡萄糖耐量改善,握力、旋转棒表现接近年轻小鼠,水迷宫认知功能提升,毛发灰白及皮肤衰老特征减轻;18月龄自然衰老小鼠干预4周后,血糖、体脂低于常规饮食组,瘦体重增加,运动及认知功能优于高脂饮食组,肝组织脂质滴沉积和炎症浸润减少,接近CR组效果。
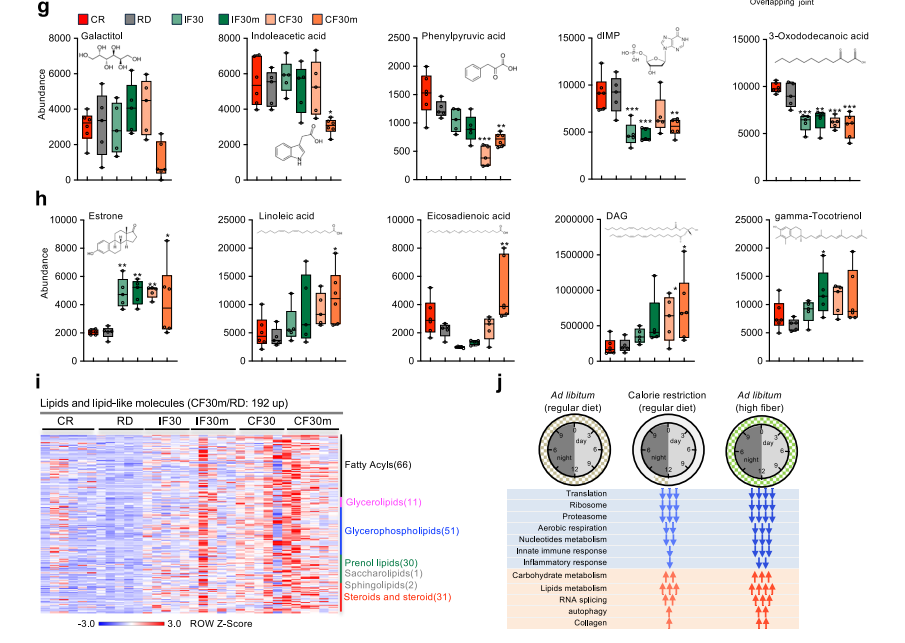
参考文献:Hu F, Yu L, Tu X, et al. A high-fiber diet mimics aging-related signatures of caloric restriction in mammals. Nat Commun. 2025
二、Nature Microbiology | 代谢重编程增强多重耐药和碳青霉烯类耐药细菌对抗生素的敏感性

碳青霉烯耐药肠杆菌科(CRE)和多重耐药菌(MDR)是全球健康的重大挑战,其对抗生素的耐药性导致疗效有限。本研究揭示了代谢重编程可增强这些耐药菌对氨基糖苷类抗生素(尤其是小诺霉素)的敏感性,发现甲酸通过激活丙酮酸甲酸裂合酶(PFL)和甲酸脱氢酶(FDH),促进CO₂生成和膜通透性增加,与小诺霉素协同杀伤耐药菌,为耐药菌感染治疗提供了新策略。
● 1. 首先研究了耐药菌的代谢特征与基因差异。碳青霉烯耐药大肠杆菌(CR-ECO)和多重耐药大肠杆菌(MDR-ECO)在丙酮酸代谢和三羧酸循环等通路中显著下调,丙酮酸、富马酸等关键代谢物水平降低,且CR-ECO异常更明显。OPLS-DA显示,丙酮酸、谷氨酸等代谢物可作为区分耐药株与敏感株的生物标志物。基因组分析进一步表明,耐药株携带多种碳青霉烯酶和代谢通路相关突变,提示代谢重编程与耐药性密切相关。
● 2. 接下来探究了丙酮酸与耐药性的关联。通过外源补充丙酮酸及基因敲除实验,发现丙酮酸可增强小诺霉素对MDR-ECO的杀伤作用,但对CR-ECO无效。机制上,丙酮酸可上调MDR-ECO中PFL和丙酮酸脱氢酶(PDH)的表达与活性,但CR-ECO中PFL和PDH的表达及活性极低,无法响应丙酮酸调控,导致其对丙酮酸不敏感。
● 3. 此外该研究还发现甲酸具有强效协同杀菌作用。体外实验显示,甲酸与小诺霉素协同作用时,对S-ECO、MDR-ECO、CR-ECO的杀伤能力分别提升约11,000倍、10,000倍和200倍,且对其他耐药菌(如肺炎克雷伯菌、铜绿假单胞菌)同样有效。机制研究表明,甲酸经分解产生的CO2和H+分别增加细菌膜通透性和质子动力势,从而促进小诺霉素的胞内摄取,而乙酸则能削弱这一效应。
● 4. 最后在动物模型中验证了甲酸的治疗潜力。感染CR-ECO或MDR-ECO的小鼠经甲酸与小诺霉素联合治疗后,脾脏、肾脏、肝脏的细菌负荷显著降低,生物膜活力下降,生存率提升超过60%,且未观察到明显毒性。
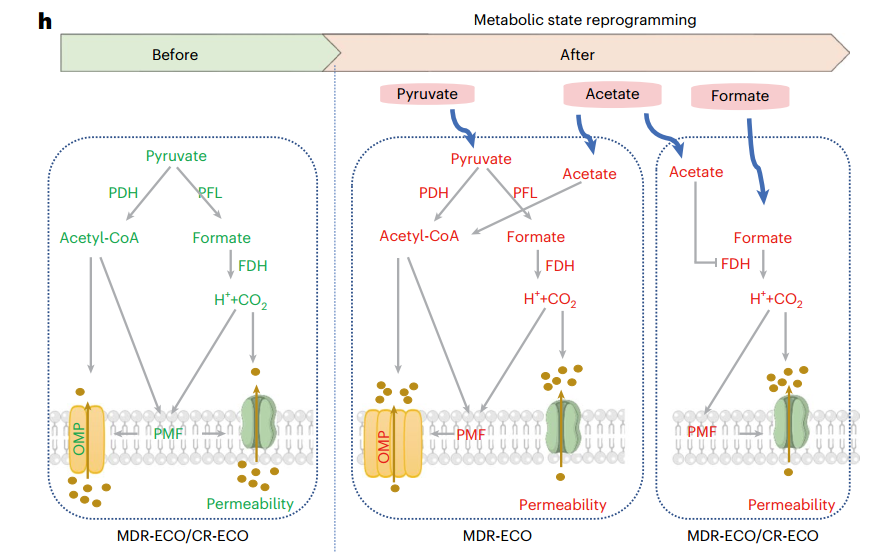
参考文献:Kuang SF, Xiang J, Li SH, et al. Metabolic reprogramming enhances the susceptibility of multidrug- and carbapenem-resistant bacteria to antibiotics. Nat Microbiol. 2025
三、Cell Metabolism | 肠道底物捕获肠菌D-乳酸改善肥胖小鼠糖代谢和脂肪肝病

肠道菌群的变化与肥胖、T2D和MAFLD密切相关。作为益生菌的重要代谢物L-乳酸在代谢中的作用已广为人知,但对另一种同分异构体D-乳酸的了解相对较少。本研究通过整合代谢组学、微生物组学以及稳定同位素示踪技术,揭示了肠道微生物产生的 D-乳酸影响宿主的葡萄糖和脂质代谢,靶向清除肠道D-乳酸可能成为改善肥胖相关代谢疾病的新途径。
● 1. 通过靶向代谢组学检测,发现肥胖小鼠和肥胖人群的血液D-乳酸水平显著升高,而L-乳酸水平无显著差异。D-乳酸能够促进肝脏中糖原和甘油三酯的合成,并且比L-乳酸更能显著提高血糖水平。
● 2. 通过稳定同位素示踪技术发现,肠道共生菌(如Lactobacillus delbrueckii)可以将13C标记的乳果糖代谢为13C标记的D-乳酸,D-乳酸随后被宿主代谢为CO2。注射[14C]-D-乳酸和[14C]-L-乳酸后,小鼠肝脏总提取物、水相、脂质相中的14C含量无显著差异。进一步研究发现,D-乳酸和L-乳酸均可在肝细胞内参与糖异生、TCA循环和脂质合成,但D-乳酸的代谢效率稍低于L-乳酸。
● 3. 对比无菌小鼠和微生物群定殖的常规化小鼠,发现肠道菌群衍生的D-乳酸是宿主血液D-乳酸的主要来源,且菌群产生的D-乳酸可导致宿主血糖升高。
● 4. 口服特定的聚乳酸可降低肥胖小鼠血糖水平,此外,PL65聚合物能捕获肠道D-乳酸,减少D-乳酸吸收,改善肥胖小鼠的血糖、胰岛素水平,减轻肝脏炎症和纤维化。
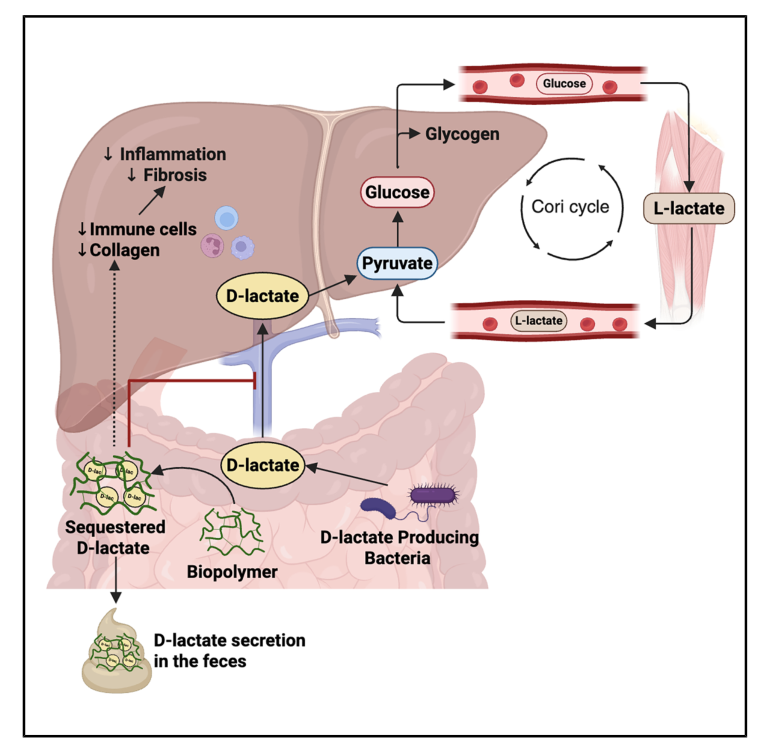
参考文献:Fang H, Anhê FF, Zada DK, et al. Gut substrate trap of D-lactate from microbiota improves blood glucose and fatty liver disease in obese mice. Cell Metabolism. 2025
四、Cell | AI揭示肠道微生物的胆汁酸代谢酶奥秘

胆汁酸的修饰对其在宿主生理和病理过程中的作用至关重要,鉴定其合成酶对于揭示胆酸的多样性以及开发靶向干预措施至关重要,但这一过程仍面临巨大挑战。本研究开发了一种人工智能(AI)辅助的工作流程——胆酸酶发布单元工具(BEAUT),预测了超过60万种潜在的胆汁酸代谢酶,并将其整合为人类通用微生物胆酸代谢酶(HGBME)数据库。该研究从酶学角度为微生物胆酸与宿主之间的关系提供了新的见解。
● 1. 首先将构建好的1032个阳性样本和108319个阴性样本进行5倍交叉验证,筛选出最优模型作为最终BEAUT工具。
● 2. 选取108株涵盖6个门的肠道菌,检测其对5种BA底物(胆酸CA、鹅脱氧胆酸CDCA、脱氧胆酸 DCA、石胆酸LCA、3-氧代脱氧胆酸3-oxoDCA)的代谢能力,发现代谢能力与BEAUT预测的阳性酶序列数量呈显著正相关。
● 3. 通过粪便宏基因组与靶向代谢组关联分析发现:3-aceCA(3-乙酰胆酸)的浓度与特定肠道菌的丰度呈显著负相关。
● 4. 进一步研究发现,ADS(3-acetoDCA合成酶)催化生成新骨架胆汁酸3-acetoDCA(3-氧代脱氧胆酸),3-acetoDCA灌胃小鼠后,粪便及结肠组织中 色氨酸代谢物吲哚3乳酸浓度显著升高。
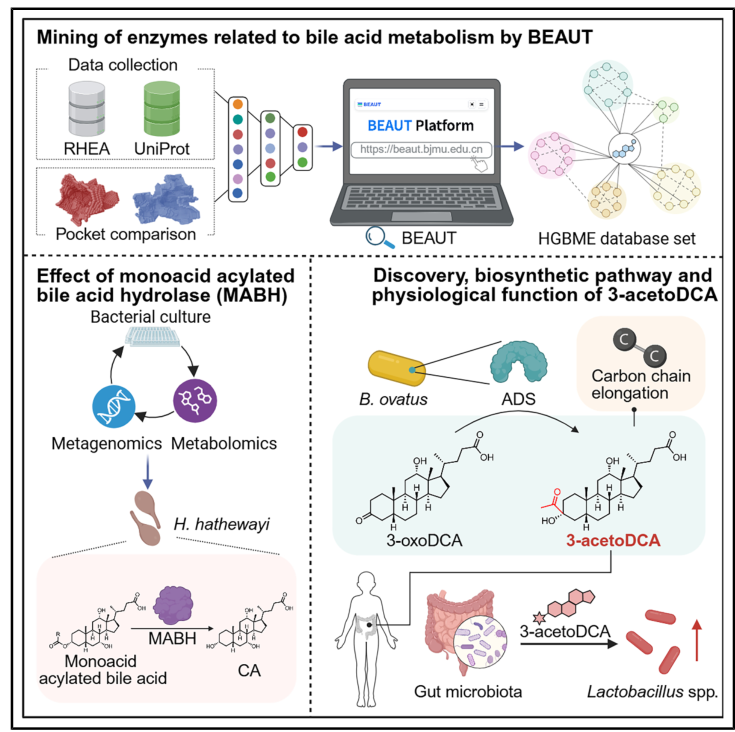
参考文献:Ding Y, Luo X, Guo J, et al. Identification of gut microbial bile acid metabolic enzymes via an AI-assisted pipeline. Cell. 2025
五、Cancer Discovery | 三氯蔗糖的摄入通过破坏肠菌使癌症的免疫疗法失效

肠道微生物群的组成与癌症免疫治疗的反应直接相关,但饮食如何影响肠道微生物群和癌症的下游免疫反应仍不清楚。本研究发现,在黑色素瘤和非小细胞肺癌(NSCLC)患者中,三氯蔗糖消耗量的增加与免疫检查点抑制剂(ICI)治疗的疗效较差相关,并阐明了三氯蔗糖如何以肠道菌群为中心的方式影响T细胞功能和ICI疗效。
● 1. 临床研究:纳入了91例晚期黑色素瘤患者、41例晚期NSCLC患者和25例高风险可切除的黑色素瘤患者,通过饮食分析以及治疗结局(客观缓解率ORR、无进展生存期PFS、无复发生存期 RFS)分析。结果表明,三氯蔗糖高摄入与免疫治疗疗效差显著相关。
● 2. 动物验证:在两种小鼠癌症模型(MC38结直肠腺癌、B16黑色素瘤)中,三氯蔗糖摄入导致小鼠对免疫治疗具有抗性,表现为肿瘤生长显著增加,且CD8+T细胞浸润减少。
● 3. 体外实验:单细胞RNA测序等结果表明,三氯蔗糖摄入导致CD8+T细胞耗竭特征增加,且对多个T细胞过程(包括增殖、细胞毒性功能和代谢)具有有害作用。
● 4. 宏基因组测序:三氯蔗糖摄入会显著改变小鼠肠道菌群组成,导致Clostridiaceae(梭菌科)和Lachnospiraceae(毛螺菌)等革兰氏阳性细菌数目增多。
● 5. 代谢组学:三氯蔗糖高摄入小鼠的粪便样本富集到了精氨酸降解途径,并且在血清和肿瘤间质液(TIF)中精氨酸水平也显著降低。补充精氨酸或瓜氨酸可以逆转这一过程,恢复免疫治疗的效果。
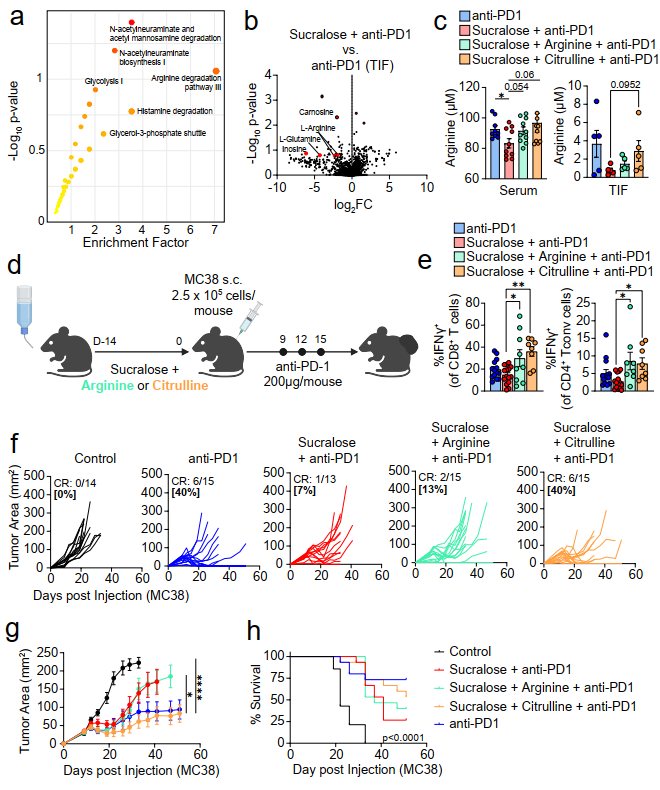
参考文献:Morder KM, et al. Overacre-Delgoffe AE. Sucralose consumption ablates cancer immunotherapy response through microbiome disruption. Cancer Discov. 2025
六、Cell Host & Microbe | 氨基酸竞争影响鲍曼不动杆菌肠道定植

抗菌素耐药性(AMR)是全球人类健康的重大威胁,鲍曼不动杆菌(Acinetobacter baumannii)作为医疗相关的机会性病原体,是AMR相关死亡的第二大直接原因。肠道被确定为鲍曼不动杆菌的储存库,但其定植的生态学机制尚不清楚。本研究表明,鲍曼不动杆菌利用鸟氨酸与肠道内的微生物群竞争,从而促进其在肠道内的定植。
● 1. 目标基因筛选与功能验证:鲍曼不动杆菌通过编码鸟氨酸琥珀酰转移酶(AstO),利用鸟氨酸作为碳源,在肠道菌群竞争中占据优势。而ΔAstO突变株无法利用鸟氨酸作为碳源,在小鼠肠道定植能力变差,但该缺陷可通过AstO回补恢复。
● 2. 动物模型验证:16S rRNA基因扩增子测序表明,补充鸟氨酸可延长鲍曼不动杆菌定植。谷氨酸/组氨酸是鲍曼不动杆菌的优选碳源,补充谷氨酸/组氨酸可完全挽救ΔAstO的定植缺陷,无需依赖鸟氨酸代谢。
● 3. 人类婴儿队列:宏基因组测序表明,鲍曼不动杆菌丰度在4月龄达到峰值,随年龄增长下降;菌群α多样性随年龄升高,与鲍曼不动杆菌丰度呈负相关。配方奶喂养组的鲍曼不动杆菌相对丰度显著高于母乳喂养组。
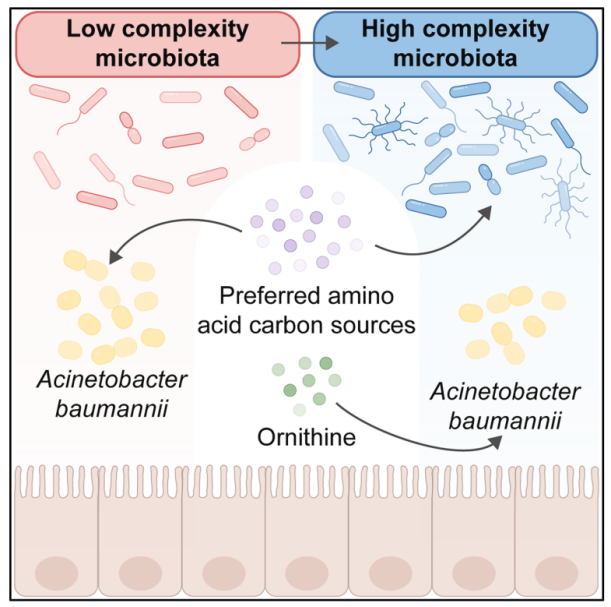
参考文献:Ren X, et al. Amino acid competition shapes Acinetobacter baumannii gut carriage. Cell Host Microbe. Cell Host & Microbe. 2025
七、Cell Metabolism | 乙酰化纤维素通过肠道共生菌消耗宿主可利用的碳水化合物来抑制体重增加

肥胖已成为全球公共健康危机,现有干预手段如生活方式调整、减肥手术或GLP-1类药物存在依从性差、费用高或可及性低等问题。传统策略多聚焦于直接调控宿主能量代谢,但近年研究发现,肠道菌群通过发酵膳食纤维产生短链脂肪酸(SCFAs),影响宿主营养吸收与能量平衡,提示调控菌群可能成为防治肥胖的新途径。然而,不同个体菌群差异大,导致传统益生元效果不稳定。此外,乙酸作为主要的SCFA之一,其对宿主代谢的影响存在争议,且此前研究多关注其系统吸收后的作用,忽视了其与肠道菌群的直接相互作用。本研究发现,一种可高效向远端肠道递送乙酸的乙酰化纤维素(AceCel),能显著抑制野生型和ob/ob肥胖小鼠的体重增长,并改善脂肪肝和高血糖等代谢紊乱。
● 1. AceCel显著抑制体重增长并改善代谢:在野生型和ob/ob肥胖小鼠中,乙酰化纤维素(AceCel)干预可减少体重、肝脏及脂肪组织质量,改善脂肪肝、高血糖和胰岛素抵抗。
● 2. 代谢效应依赖肠道菌群:AceCel的减重和改善代谢作用在无菌小鼠中消失,而在单菌定植Bacteroides的小鼠中重现,表明其效应需依赖肠道菌群。
● 3. AceCel重塑菌群组成:AceCel显著富集拟杆菌目(Bacteroidales),特别是Bacteroides thetaiotaomicron等菌株,减少双歧杆菌等潜在有益菌。
● 4. 乙酸促进拟杆菌糖代谢:体外及体内实验显示,AceCel释放的乙酸可上调拟杆菌的糖摄取与代谢基因(如susG、susB、glkA),增强其消耗葡萄糖及双糖的能力。
● 5. 肠道单糖耗竭驱动宿主代谢转变:AceCel降低肠道可吸收单糖(葡萄糖、蔗糖、麦芽糖)水平,减少门静脉葡萄糖输入,促使肝脏以脂肪酸氧化供能。
● 6. 不依赖传统SCFA受体或食欲改变:AceCel的代谢效应不依赖GPR41/43等短链脂肪酸受体,也不通过减少摄食量实现,提示其机制与传统益生元不同。
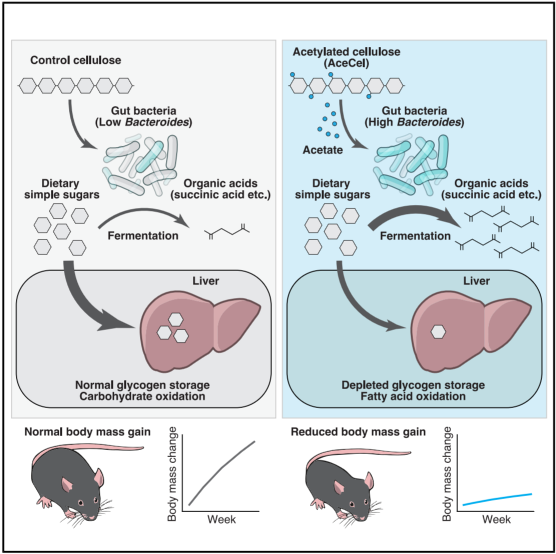
参考文献:Takeuchi, T., Miyauchi, E., Nakanishi, Y., et al. Acetylated cellulose suppresses body mass gain through gut commensals consuming host-accessible carbohydrates. Cell Metabolism. 2025
八、Cell Reports | 葡萄糖激活的JMJD1A通过α-酮戊二酸依赖的染色质重塑驱动内脏脂肪生成

肥胖相关的脂肪扩张存在两种模式:脂肪细胞肥大(hypertrophy)与增生(hyperplasia)。肥大易诱发炎症和代谢紊乱,而增生则被视为更健康的适应性反应,但其调控机制尚不明确。本研究发现,葡萄糖作为脂肪细胞分化的主要能量来源,其代谢产物α-酮戊二酸(α-KG)可激活组蛋白去甲基化酶JMJD1A,提示存在一条“代谢-表观遗传”通路,可能决定脂肪细胞的命运。
● 1. 葡萄糖驱动α-KG积累:高脂条件下,葡萄糖通过TCA循环-IDH3通路促进α-KG在胞核内积聚。
● 2. JMJD1A激活与表观重塑:α-KG激活JMJD1A,特异性去除H3K9me2抑制标记,开启脂肪生成与糖酵解基因(Pparg、ChREBP靶基因)的表达。
● 3. NFIC介导招募:转录因子NFIC预标记靶基因位点,招募JMJD1A,建立可受葡萄糖调控的染色质环境。
● 4. ChREBP正反馈放大:JMJD1A去甲基化后,促进葡萄糖感应转录因子ChREBP结合,进一步放大糖酵解-脂肪生成程序。
● 5. 体内功能验证:脂肪前体细胞特异性缺失JMJD1A的小鼠在高糖高脂饮食下,内脏脂肪新生受阻,表现为肥大和炎症加剧;而皮下脂肪受影响较小,证实JMJD1A介导的增生扩张具有部位特异性。
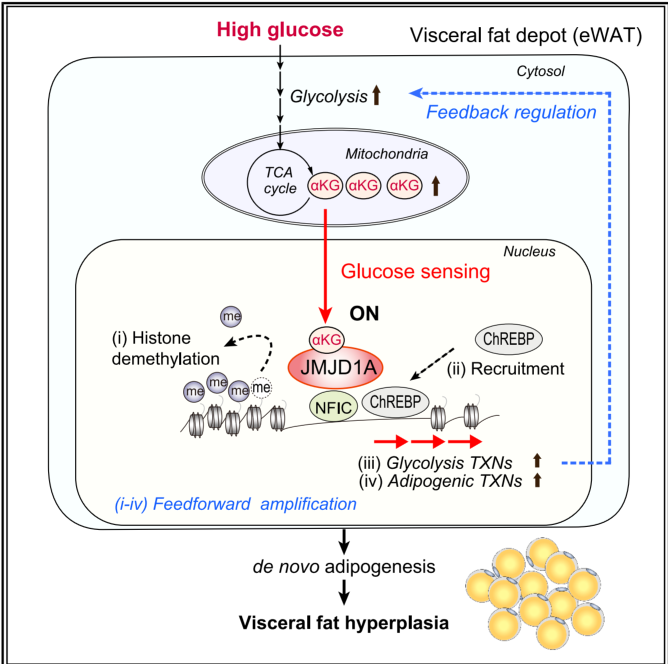
参考文献:Yang, C., Arai, M., Ariyanto, E. F., et al. Glucose-activated JMJD1A drives visceral adipogenesis via α-ketoglutarate-dependent chromatin remodeling. Cell Reports. 2025
